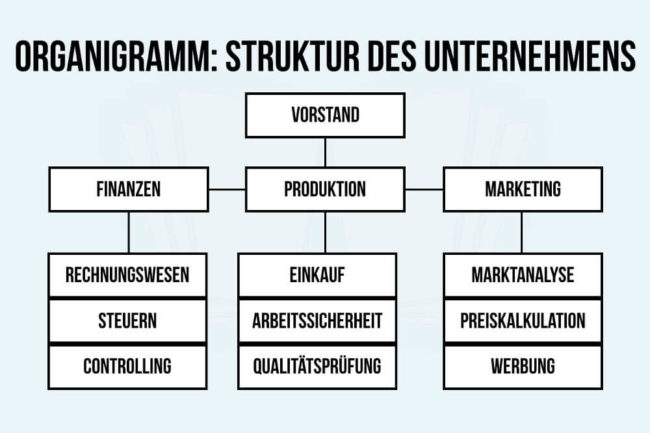
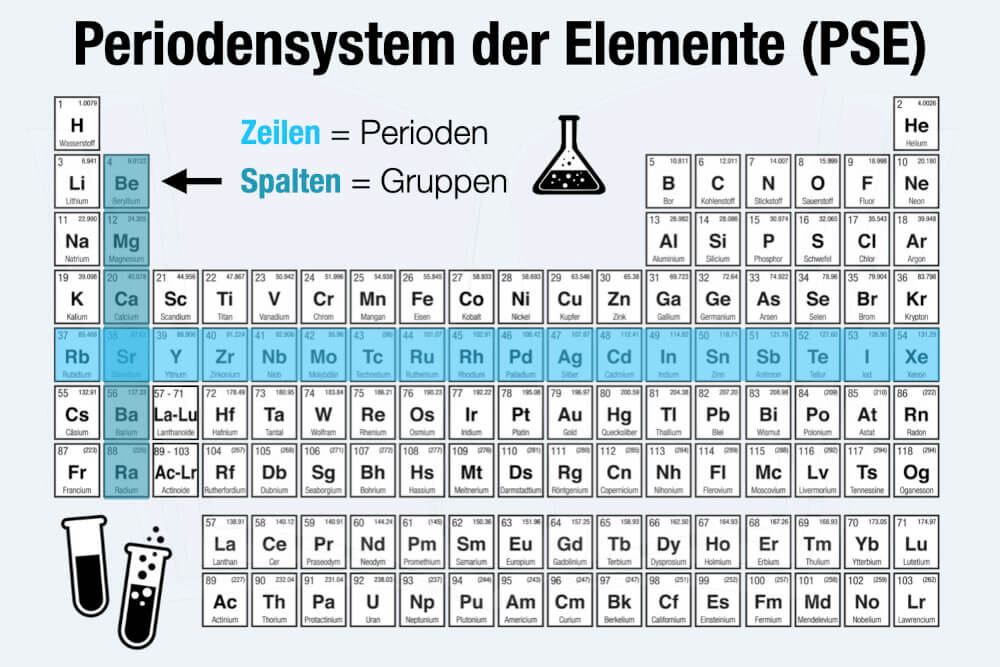
Das Periodensystem der Elemente
Das Periodensystem der Elemente (PSE) stellt alle chemischen Elemente in einer übersichtlichen Tabelle dar. Aktuell enthält das PSE 118 Elemente der Chemie in 8 Hauptgruppen und 10 Nebengruppen.
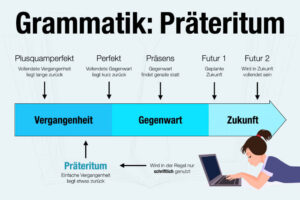
Periodensystem heißt die Übersicht, weil bestimmte Eigenschaften der Elemente „periodisch“ sind, also regelmäßig wiederkehrend. Das PSdE geht ursprünglich zurück auf die Entwürfe von Dimitri Mendelejew und Lothar Meyer (1869).
Eingeteilt wird das Periodensystem nach:
- Zeilen (= Perioden) mit aufsteigender Ordnungszahl.
- Spalten (= Gruppen) mit ähnlichen chemischen Eigenschaften.
Die Elemente im PSE stehen in einem eigenen Kästchen (sog. Elementkarten), das durch das Elementsymbol und die jeweilige Ordnungszahl (links oben) gekennzeichnet ist.
Erklärung des PSE
Das erste Element im Periodensystem (oben links) ist Wasserstoff mit der Ordnungszahl 1. Sein Elementsymbol lautet H (zum Vergrößern bitte anklicken):
Periodensystem zum Ausdrucken (PDF)
Auf den jeweiligen Elementkarten im PSE finden Sie zusätzliche Informationen zu den jeweiligen Elementen: Zum Beispiel das Elementsymbol, darunter dessen Elementname sowie rechts oben das Atomgewicht.
Periodensystem Aufbau und Beschriftung
Die Einteilung des Periodensystems gliedert sich in Perioden und Gruppen:
- Es gibt insgesamt sieben Perioden. Diese werden horizontal von oben nach unten angeordnet.
- Die acht Hauptgruppen stehen vertikal in Spalten nebeneinander und sind von links nach rechts aufgebaut.
Die zehn sogenannten Nebengruppen sind zwischen der zweiten und dritten Hauptgruppe angeordnet. Auch deren Elemente werden nach ihrer Ordnungszahl sortiert.
Gelesen wird das Periodensystem der Elemente von links nach rechts bzw. von oben nach unten. Wo ein chemisches Element angeordnet ist, hängt von der Anzahl der Protonen im Atomkern ab: Oben links das Element mit der kleinsten Ordnungszahl bzw. geringsten Protonen-Anzahl: Wasserstoff (H) enthält nur ein Proton; Helium (He) in derselben Periode enthält zwei Protonen, daher die Ordnungszahl 2.
Ordnungszahl
Die Ordnungszahl (OZ, auch: Kernladungszahl) gibt die Anzahl der Protonen (positiv geladene Teilchen) in einem Atom an. Die Protonen befinden sich im Atomkern, ihr Gegenstück – die Elektronen (negativ geladenen Teilchen) – liegen in der Atomhülle.
Atome, deren Ordnungszahlen identisch sind, gehören zum gleichen chemischen Element. Besitzt ein Atom dieselbe Anzahl an Protonen und Elektronen ist es elektrisch neutral. Auch das gibt die Ordnungszahl an: Das Wasserstoffatom (Ordnungszahl 1) hat zum Beispiel ein Proton und ein Elektron.
Die Ordnungszahl im Periodensystem steigt innerhalb einer Periode von links nach rechts mit jedem Element um eins. Sind Sie am Ende einer Periode angekommen, beginnen Sie in der nächsten Reihe auf der linken Seite darunter und es geht mit der nächsthöheren Ordnungszahl weiter.
Perioden
Im Periodensystem der Elemente gibt es insgesamt sieben Perioden. Sie sind von oben nach unten angeordnet und basieren auf dem sog. Schalenmodell. Danach bewegen sich die Elektronen auf „Schalen“ (auch: Schichten) um den Atomkern – ähnlich wie die Schalen einer Zwiebel.
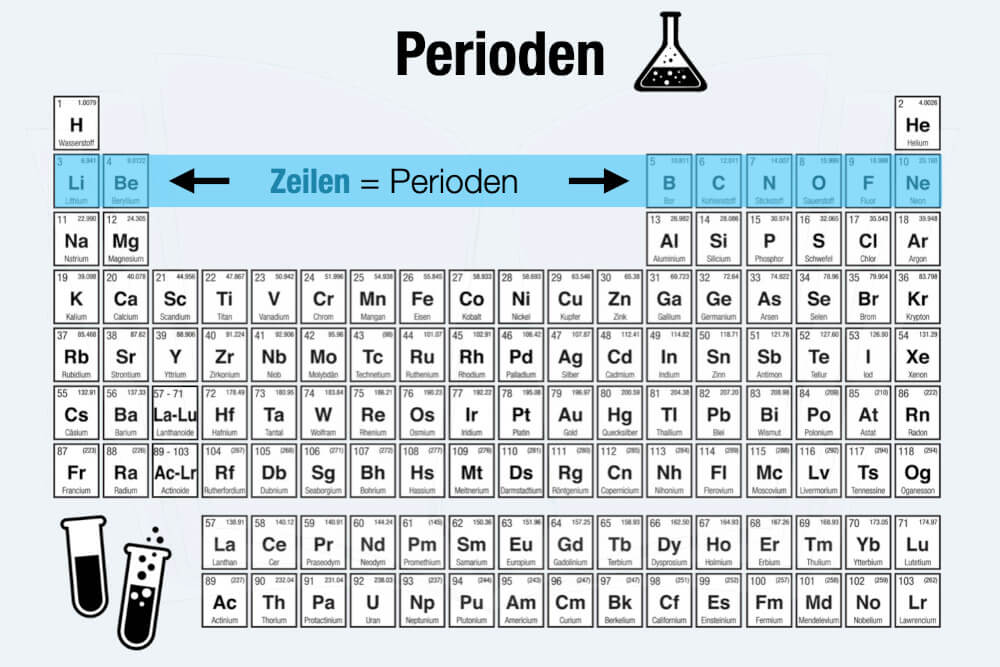
Die Anzahl der Atomschalen wird bestimmt durch die Anzahl der Elektronen, denn jede Schale kann nur eine begrenzte Zahl an Elektronen aufnehmen. Ist deren Kapazität erschöpft, springt ein Element in die nächste Periode links beginnend im PSE. Entsprechend gibt die Anzahl der Perioden zugleich die Anzahl der Schalen an.
Verteilung der Elektronen in Schalen
Im Periodensystem können Sie zugleich ablesen, wie viele Schalen ein Element für seine Elektronen benötigt. Anschaulich verdeutlichen lässt sich das am Beispiel der Edelgase Helium (He) und Neon (Ne):
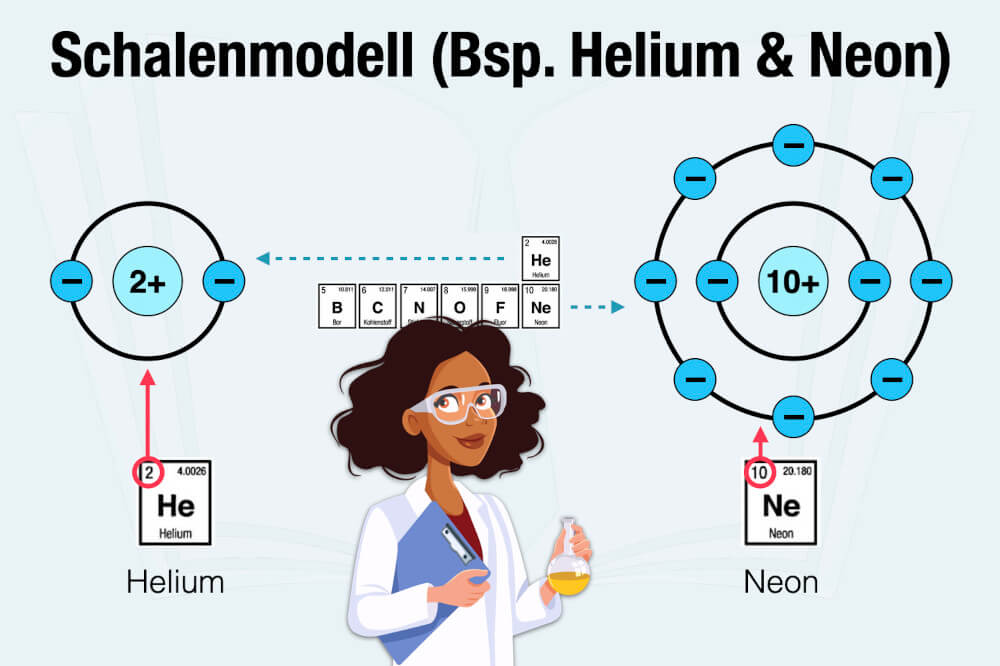
Das Element Helium (He) gehört noch zur ersten Periode und hat die Ordnungszahl 2. Danach hat die erste Schale nur Platz für zwei Elektronen. Sie wird auch „K-Schale“ genannt. Alle weiteren Schalen werden nach den weiteren Buchstaben in alphabetischer Reihenfolge benannt.
Das Element Neon (Ne) gehört bereits zur zweiten Periode. Bedeutet: Zu der K-Schale kommt noch eine L-Schale, die weitere 8 Elektronen besitzt. Daher auch die Ordnungszahl 10 (2 + 8 = 10).
Gruppen (Elementgruppen im PSE)
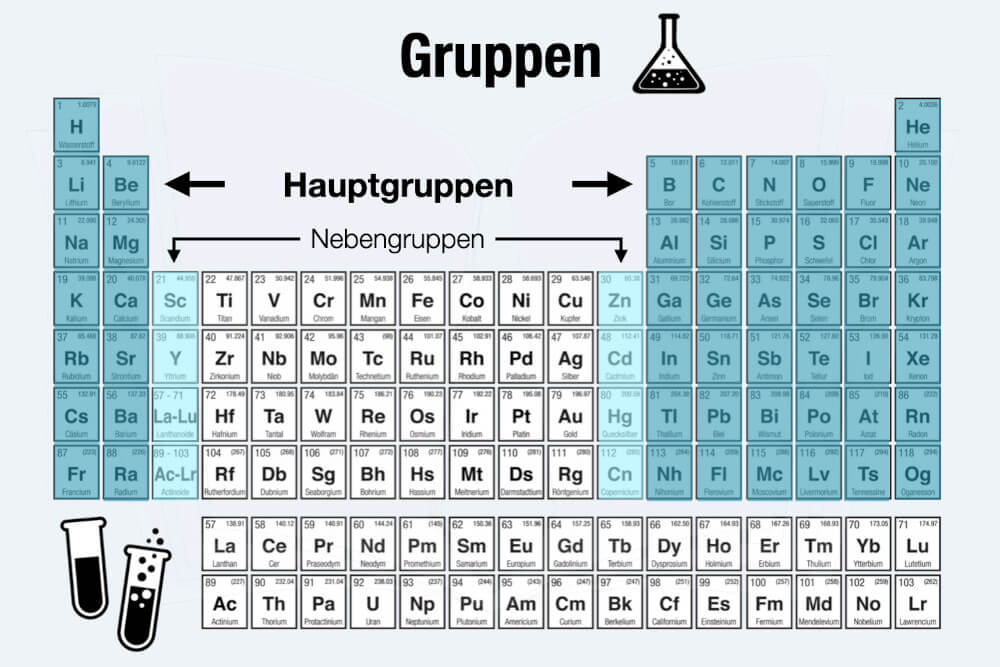
Neben den Perioden (waagerecht) befinden sich im PSE ebenso die sog. Elementgruppen. Sie sind senkrecht in Spalten angeordnet und von links nach rechts durchnummeriert.
Insgesamt enthält das Periodensystem derzeit 18 Elementgruppen, die sich aus acht Hauptgruppen und zehn Nebengruppen zusammensetzen. Die Nebengruppen liegen in den Spalten 3 bis 12. Elemente derselben Gruppe haben in der Regel gleiche chemische Eigenschaften und weisen ähnliche chemische Reaktionen auf.
Hauptgruppen
Die Gruppen 1, 2, 13 bis 18 zählen zu den Hauptgruppen. Sie können ebenso gut als I A, II A, III A bis VIII A gekennzeichnet sein. Zu ihnen gehören:
| Hauptgruppe | Gruppenname |
| 1. Hauptgruppe (1 / I A) | Alkalimetalle |
| 2. Hauptgruppe (2 / II A) | Erdalkalimetalle |
| 3. Hauptgruppe (13 / III A) | Bor-Aluminium-Gruppe |
| 4. Hauptgruppe (14 / IV A) | Kohlenstoffgruppe |
| 5. Hauptgruppe (15 / V A) | Stickstoffgruppe |
| 6. Hauptgruppe (16 / VI A) | Chalkogene |
| 7. Hauptgruppe (17 / VII A) | Halogene |
| 8. Hauptgruppe (18 / VIII A) | Edelgase |
Nebengruppen
Die Gruppen 3 bis 12 bilden die sogenannten Nebengruppen. Benannt sind die Nebengruppen jeweils nach dem obersten Element. In der 8. Gruppe ist das zum Beispiel Eisen (Fe). Daher der Name „Eisengruppe“.
| Nebengruppe | Gruppenname |
| 1. Nebengruppe (3) | Scandiumgruppe |
| 2. Nebengruppe (4) | Titangruppe |
| 3. Nebengruppe (5) | Vanadiumgruppe |
| 4. Nebengruppe (6) | Chromgruppe |
| 5. Nebengruppe (7) | Mangangruppe |
| 6. Nebengruppe (8) | Eisengruppe |
| 7. Nebengruppe (9) | Kobaltgruppe |
| 8. Nebengruppe (10) | Nickelgruppe |
| 9. Nebengruppe (11) | Kupfergruppe |
| 10. Nebengruppe (12) | Zinkgruppe |
Elementkarte
Jedem Element ist im Periodensystem eine eigene Elementkarte zugeordnet. Diese ist immer nach demselben Muster aufgebaut:
- Links oben: Ordnungszahl (Kernladungszahl)
- Rechts oben: Atomgewicht (Atommasse)
- Mitte: Elementsymbol
- Unten: Elementname
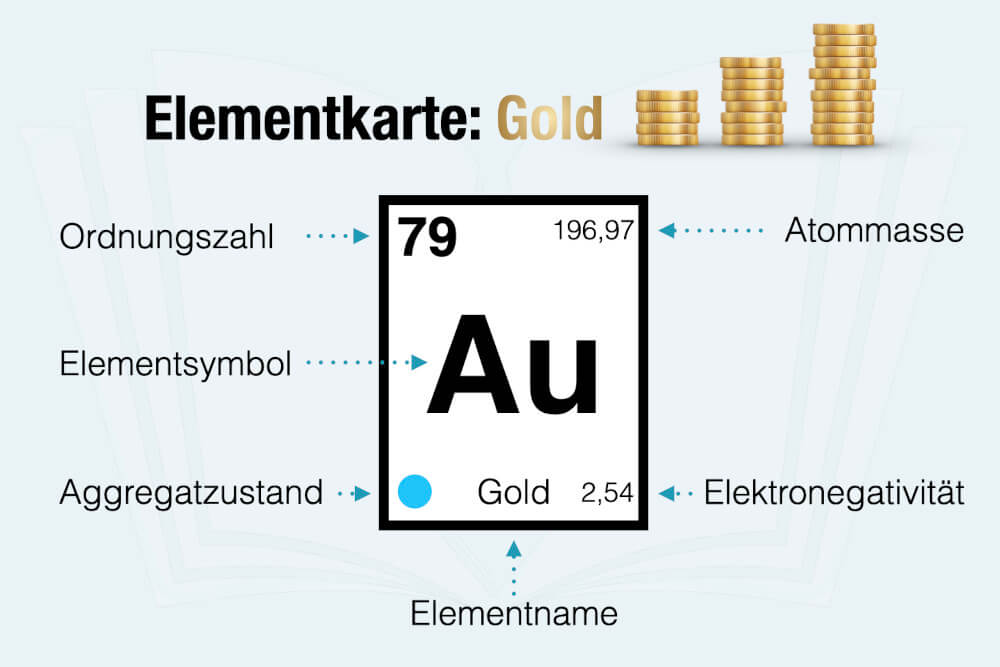
Die Elementsymbole lassen sich teilweise direkt aus dem Namen ableiten: „Na“ für Natrium, „Cl“ für Chlorid. Andere Kürzel basieren auf lateinischen bzw. griechischen Namen – „Au“ für „aureum“ (= Gold) oder „H“ für „hydrogenium“ (= Wasserstoff) oder „O“ für „oxygeni“ (= Sauerstoff).
In manchen Periodensystemen finden sich zudem noch farbliche Kennzeichnungen (links unten) für den Aggregatzustand – also zum Beispiel fest, flüssig oder gasförmig – sowie ein Wert für die Elektronegativität (rechts unten). Diese beschreibt, wie stark ein Element die Elektronen einer chemischen Verbindung für sich beansprucht. Zu den elektronegativsten Elementen gehört übrigens Sauerstoff mit einem Wert von 3,44.
Was sind Trends im Periodensystem?
Die chemischen Eigenschaften der jeweiligen Elemente verändern sich im Periodensystem – innerhalb einer Periode (von links nach rechts) sowie innerhalb ihrer Elementgruppe (von oben nach unten). Diese Veränderung der Eigenschaften folgen einem sogenannten „Trend“.
Die folgenden Trends gelten zunächst nur für die Elemente der Hauptgruppe:
-
Atomradius
Der Atomradius nimmt von oben nach unten und innerhalb einer Gruppe zu. Er beschreibt die Elektronenschalen, die sich immer weiter vom Atomkern entfernen. Somit steigt auch der Radius.
-
Ionisierungsenergie
Die Ionisierungsenergie beschreibt den Energieeinsatz, den es braucht, um ein Elektron aus der äußersten Schale eines Atoms zu lösen. Die Ionisierungsenergie nimmt innerhalb einer Gruppe von oben nach unten ab, weil der Atomradius steigt und die äußeren Elektronen eine immer schwächere Anziehung zum Kern besitzen.
-
Elektronegativität
Auch die Elektronegativität nimmt innerhalb einer Gruppe von oben nach unten ab. Von links nach rechts und innerhalb der Periode nimmt sie allerdings zu. Die höchste Elektronegativität hat das Element Fluor.
Was andere dazu gelesen haben